El ictus es una de las primeras causas de deterioro cognitivo y demencia y, ahora, un equipo de neurocientíficos dirigido por la profesora María Ángeles Moro, del departamento de Farmacología y Toxicología y del Instituto de Investigación Neuroquímica de la UCM, y también adscritos al Instituto de Investigación del Hospital 12 de Octubre i+12, ha demostrado en roedores que esto es debido a que el ictus desencadena una neurogénesis alterada o aberrante que es responsable del posterior deterioro cognitivo.
Una de las principales regiones cerebrales implicadas en las funciones cognitivas, como la memoria y el aprendizaje, es el hipocampo. A través del proceso conocido como neurogénesis (generación de nuevas neuronas), las neuronas se añaden continuamente a los circuitos del hipocampo, contribuyendo a almacenar nuevos recuerdos.
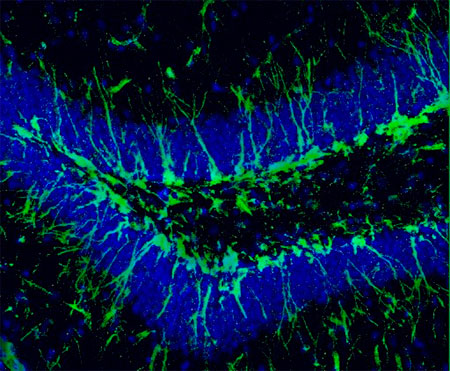
En el cerebro de los mamíferos adultos, el hipocampo es una de las principales regiones implicadas en las funciones cognitivas. La neurogénesis del hipocampo adulto ocurre en una región de esta estructura conocida como giro dentado (GD), específicamente, en la zona subgranular (ZSG), la cual se considera una fuente de nuevas neuronas de la mayoría de los mamíferos, incluidos los humanos, y durante la fase crónica del ictus (semanas-meses), hay un aumento de la respuesta neurogénica en la ZSG.
En su laboratorio, la profesora Moro y su equipo observaron que el ictus experimental en ratones ocasiona la pérdida sostenida de la memoria, con un declive progresivo y persistente de las funciones cognitivas que se asemeja al observado en humanos.
Este estudio del equipo de la UCM pone de manifiesto que se produce un proceso de remodelado neuronal patológico, con características opuestas a uno y otro lado del hipocampo. Así, las nuevas neuronas generadas en un entorno “hostil” como consecuencia del daño cerebral ocasionado por el ictus desarrollan alteraciones morfológicas y se integran anormalmente en los circuitos neuronales, lo que explicaría la pérdida de la memoria dependiente de hipocampo. De este modo, con este estudio los autores han demostrado que, si en estas circunstancias impedimos la generación de nuevas neuronas, se previene el deterioro cognitivo en estos animales.
Este novedoso hallazgo demuestra, por primera vez, mecanismos claves que explican la pérdida de memoria posterior al ictus, abriendo nuevas líneas de investigación para el desarrollo de tratamientos para esta discapacidad, que afecta tanto al paciente como a su entorno, y con una enorme repercusión sociosanitaria.
El ictus es una enfermedad cerebrovascular que se produce por la disminución u obstrucción del flujo sanguíneo, con una elevada incidencia en todo el mundo. Según la OMS, 15 millones de personas sufren un ictus cada año en el mundo. De ellas, 5 millones morirán y otros 5 millones quedarán con discapacidades permanentes.
Tal y como indican desde la Unidad de Investigación Neurovascular de la UCM, las repercusiones socioeconómicas del ictus son de primer orden, ya que, además de la elevada mortalidad (en España es la primera causa de muerte en mujeres y la tercera en hombres), es el condicionante más importante de los casos de invalidez permanente y es la segunda causa de demencia después de la enfermedad de Alzheimer.
Este nuevo hallazgo, publicado en The Journal of Clinical Investigation, aporta dianas terapéuticas para la prevención y el tratamiento de las demencias posteriores al ictus y puede aportar pistas sobre los mecanismos subyacentes a otros trastornos cognitivos donde la neurogénesis hipocampal se vea afectada.
Esta investigación se ha desarrollado por la Unidad de Investigación Neurovascular de la UCM (Grupo de Enfermedades Neurovasculares de i+12), dirigida por los profesores María Ángeles Moro e Ignacio Lizasoain, y con la colaboración del SickKids Hospital de Toronto.
REFERENCIA:
Cuartero MI*, De La Parra J*, Pérez-Ruiz A*, Bravo-Ferrer I, Durán-Laforet V, García-Culebras A, García-Segura JM, Dhaliwal J, Frankland PW, Lizasoain I, Moro MA. Abolition of aberrant neurogenesis ameliorates cognitive impairment after stroke in mice. J Clin Invest. https://doi.org/10.1172/JCI120412.



